Helicobacter Test INFAI®
Helicobacter Test INFAI ist ein Atemtest zum direkten, nicht-invasiven Nachweis des Bakteriums Helicobacter pylori und ist heute ein Standard in der Diagnose und einer der am meistverwendeten ¹³C-Harnstoff-Atemtests weltweit. Der Helicobacter Test INFAI (HTI) ist erstmalig von INFAI 1997 in allen europäischen Ländern im zentralisierten Verfahren von der EMA zugelassen und steht für die Routinediagnostik einer Helicobacter pylori-Infektion zur Verfügung. Mittlerweile ist die HTI in über 40 Ländern außerhalb der EU zugelassen und wird von den meisten Krankenkassen übernommen. Das Testkit wurde für die einfache Anwendung durch Krankenhäuser und Ärzte optimiert.

Eigenschaften
International zugelassen
Helicobacter Test INFAI ist als erstes Produkt bei EMA 1997 im Rahmen eines zentralen Verfahrens in allen Ländern der Europäischen Union zugelassen. Die Zulassung wurde außerhalb der EU auf 40 Länder erweitert.
Einfach in der Anwendung
Das einfache und patientenfreundliche Testprotokoll erlaubt einen hohen Grad an Zuverlässigkeit. Er besitz eine hohe Sensitivität und Spezifität gegenüber anderen nicht invasiven Tests.
Keine Gegenanzeigen
Es sind keine Gegenanzeigen bekannt.
Hohe Sensitivität und Spezifität
Die hohe Sensitivität und Spezifität
des Tests beim Nachweis von aktiven Helicobacter-pylori-Infektionen machen ihn zum neuen Goldstandard bei nicht invasiven Tests.
Erstmals für Kinder zugelassen
Helicobacter Test INFAI ist erstmals für Kinder im Alter von 3-17 Jahren durch die EMA EU-weit zugelassen. Bis heute ist es der einzige offiziell zugelassene Test für Kinder im Alter von 3-17 Jahren.
Nicht invasiv
¹³C-Harnstoff ist natürlicherweise im menschlichen Körper vorhanden, so dass keine schädlichen Nebenwirkungen zu erwarten sind. Der Test kann bei Kindern und während der Schwangerschaft und Stillzeit verwendet werden.
Bester zuverlässiger Test zur Kontrolle einer Hp-Eradikation
Kostengünstig
In vielen Fällen kann ein Atemtest eine Helicobacter pylori-Infektion anzeigen, ohne auf die Endoskopie zurückgreifen zu müssen.
Einer der meistverwendeten ¹³C-Harnstofftest weltweit
Helicobacter Test INFAI ist ein Atemtest zum direkten, nicht invasiven Nachweis des Bakteriums Helicobacter pylori. Der Test ist ein medizinisches Produkt und wurde durch die Europäische Kommission 1997 als erstes Originalprodukt zugelassen und in das Arzneimittelregister aller Länder der Europäischen Union aufgenommen. In Folge wurde der INFAI Test in vielen Ländern außerhalb der EU zugelassen. Helicobacter Test INFAI ist einer der meistverwendeten ¹³C-Harnstoff Atemtest weltweit und heute ein Standard in der nicht-invasiven Diagnose von Helicobacter pylori Infektionen. Der Test wurde bis heute ca. 7.0 mio verkauft. Das Testkit wurde für die einfache Verwendung durch Krankenhäuser und Ärzte optimiert. Atemtests können in einem entsprechend ausgerüsteten Krankenhaus-Labor durchgeführt oder an ein qualifiziertes Labor gesendet werden.
Video
Durchführung des Helicobacter Test
Das folgende Video zeigt die Durchführung des Helicobacter Test INFAI im Rahmen einer klinischen Studie in Nottingham (Titel: HEAT Study; Helicobacter eradication to prevent ulcer bleeding in aspirin users: a large simple randomised controlled trial. Sponsor: University of Nottingham, EudraCT Number: 2011-003425-96).
An dieser Studie haben im United Kingdom 40.000 Probanden teilgenommen und MS-Messungen und Analysen wurden in den INFAI-Laboren in York, England durchgeführt.
Dumbleton J.S., et al. (2015): The Helicobacter Eradication Aspirin Trial (HEAT): A Large Simple Randomised Controlled Trial Using Novel Methodology in Primary Care. EBioMedicine 2: 1200–1204.
Sie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden. Mehr Informationen
Klinische Indikationen für INFAI
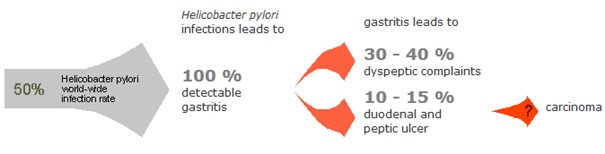
Helicobacter Test INFAI weist eine Mageninfektion durch das Bakterium Helicobacter pylori nach, das als Hauptverursacher der meisten Arten von Magengeschwüren, Magenkrebs und Darmkrebs gilt. Magenkrebs ist weltweit die dritthäufigste krebsbedingte Todesursache, und über 80 % der Magenkrebsfälle werden einer H. pylori-Infektion zugeschrieben. Der ¹³C-Harnstoff Atemtest ist nicht invasiv und nicht radioaktiv und wird von führenden gastroenterologischen Vereinigungen zur Verwendung sowohl vor als auch nach einer Eradikationsbehandlung empfohlen.
Management of Helicobacter pylori infection The Maastricht V / Florence Consensus Report, Gut 2017
Produktion von Helicobacter Test INFAI
Qualitätsgesicherte Produktion
Ausgerüstet mit einer hochmodernen automatisierten Produktionsstraße und überwacht durch erfahrene und hochqualifizierte Mitarbeiter, bietet INFAI einen registrierten ¹³C-Harnstoff-Atemtest an, der von höchster pharmazeutischer Qualität und Zuverlässigkeit ist. Ein Qualitätsmanager und ein QPPV garantieren volle Einhaltung unserer internen Betriebsverfahren. Regelmäßige Qualitätskontrollen durch externe Audits werden von lokalen Behörden, Bundesbehörden (BfArM) und der EMA durchgeführt.
Produktion des ¹³C-Harnstoff-Atemtests
Das folgende Video gibt einen Überblick über die neue moderne Produktionsanlage in Hagen sowie die Durchführung des ¹³C-Harnstoff-Atemtests und Analyse anhand IRMS und IR-Spektroskopie-Methode. Das Kit wird gleichzeitig für das jeweilige Land nach europäischen Richtlinien serialisiert.
Sie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden. Mehr Informationen
Qualitätskriterien von Helicobacter Test INFAI
Die Spezifität (98,5%) und Sensitivität (97,9%) von Helicobacter Test INFAI gleichen traditionellen invasiven diagnostischen Methoden (Endoskopie und Biopsie). Da der Atemtest den augenblicklichen Status einer Helicobacter pylori-Infektion anzeigt, kann er zur Bestätigung einer erfolgreichen Eradikation vier Wochen nach Beendigung der Behandlung verwendet werden.
Ein neuer Atemtest mit neuer Testmahlzeit (Refex®) für Patienten, die PPI nehmen
50 % aller dyspeptischen Patienten nehmen dauerhaft Protonenpumpeninhibitoren (PPI). Die Einnahme von PPI verursacht eine signifikante Verringerung der Sensitivität von nicht-invasiven Methoden zur Diagnose von H.p.–Infektion, wie ¹³C-Harnstoff-Atemtests und Stuhltests. Für den Nachweis von H.p. bei Patienten mit Dyspepsie war daher ein Absetzen der PPI für 14 Tage erforderlich. Eine neue Formulierung von Helicobacter Test INFAI überwindet nun diese Unannehmlichkeit und bietet die folgenden Vorteile für Patienten, die PPI einnehmen:
- Nur eintägige PPI-Medikamentenpause nötig
- Einfache Durchführung genauso wie bisher
- Sichere und zuverlässige Diagnose von H.p.-Infektionen
Für die Patienten, die PPI einnahmen, wurden zwei klinische Studien durchgeführt (siehe PPI-Flyer, Publikation und EU-Patent). Wir haben die Variation Type II bei der EMA beantragt und hoffen auf eine baldige Zulassung.
Comparison of INFAI and Diabact
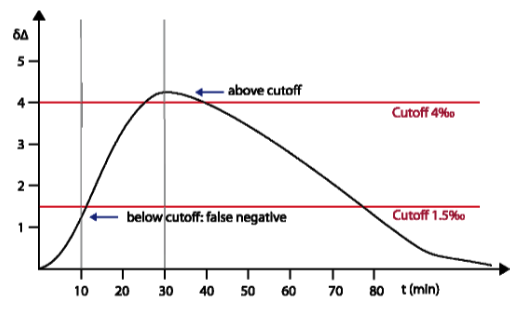
Comparison of INFAI and Diabact Breathtest Diabact uses for the test performance a cut-off point of Δδ= 1.5 ‰ and a sampling time of 10 minutes with a reduced dose (50 mg) of ¹³C-urea for detection of Helicobacter pylori. This test design is not sufficient to get correct results; the short sampling time and lower cut-off point can cause false negative results. This is because maximum urease activity takes between 20 and 30 minutes (also reported by V. Skar et al., Helicobacter 14 (4), 339, 2009). In the beginning, Diabact approved a dose of 2 x 50 mg ¹³C-urea. Later the dose was reduced to 50 mg. This low dose does not reach accuracy sufficient to be recommended in daily practice. In particular it can cause wrong results for patients with a high body weight. Especially after eradication therapy when H. pylori colonization rate is reduced, the overlapping between H. pylori positive and negative results is high, when Diabact test is performed. INFAI validated the cut-off point of Δδ= 4 ‰, a dose of 75 mg ¹³C-urea and a sampling time of 30 minutes by testing more than 9000 patients in several clinical trials inorder to achieve maximum sensibility and specifity. This corresponds with the values most used in the literature (see also scientific discussion at EMA).
Another problem is the application of the ¹³C-urea tablets (by Diabact), which contain citric acid, as the tablet doesn’t dissolve completely within 5 minutes in the stomach fluid. The resulting real residence time in the antrum area and therefore contact to it is too short (10 minutes sampling time) and there’s also no considerable contact to the other stomach areas (fundus). It is known that H. pylori is not equally distributed over all areas in the stomach. Therefore the contact of the ¹³C-urea to all stomach areas is necessary in order to achieve correct results. This is not given by using the Diabact performance. In the INFAI test performance, the patient drinks first citric acid in 200 ml water, then a solution of 75 mg ¹³C-urea in water, so there is no loss of efficiency because all stomach areas are in contact with the dissolved ¹³C-urea.
Formulierung des Heliobacter Test INFAI
Die folgenden Formulierungen vom Helicobacter Test INFAI sind in der Europäischen Union und vielen anderen Ländern erhältlich:

Helicobacter Test INFAI CLINIPAC 50
Wegen steigender Nachfrage bietet INFAI jetzt Großpackungen für klinische Apotheken und Gemeinschaftspraxen an.
- Speziell für Allgemeinärzte, Labors und Krankenhäuser
- Kostengünstig, Einsparungen von 20-25% im Vergleich zu einzelnen Tests
- Enthält Testmaterialien zur Diagnose von 50 Patienten
- Sicher und zuverlässig

Qualitätsmanagement und Zertifizierung
Im Mai 1999 schloss die INFAI GmbH erstmalig das Audit zur Zertifizierung nach DIN EN ISO 9001 erfolgreich ab. Das eingeführte Qualitätsmanagementsystem umfasst alle Unternehmensbereiche einschließlich Produktion, Forschung und Entwicklung, Vertrieb und Service. Die im Rahmen dieses Systems festgelegten hohen Qualitätsstandards gewährleisten die Herstellung sicherer und hochwertiger pharmazeutischer Produkte. Die Zufriedenheit unserer Kunden, und gute Beziehungen zu Angestellten, Vertriebspartnern und Zulieferern stehen im Mittelpunkt unserer Tätigkeiten.

Mehr Informationen
Fachinformation und Patienteninformation:(Aktuelle Versionen bei der EMA in verschiedenen Sprachen)
Serialisierung
Umsetzung der Fälschungsschutzrichtlinie der Europäischen Union-neue Verpackungslinie INFAI
Seit dem 9.Februar 2019 ist die Fälschungsschutzrichtlinie der Europäischen Union (Richtlinie 2011/62/EU) in Kraft. Sie soll kriminellen Fälschern von Arzneimitteln zum Wohle der Patienten das Handwerk legen. Die Fälschungsschutzrichtlinie betrifft alle rezeptpflichtigen Arzneimittel.
Zur Umsetzung wird jede Packung des Arzneimittels mit einem Originalitätsnachweis auf der Außenverpackung versehen. Dieser Originalitätsnachweis wird bei dem Helicobacter Test INFAI durch die Cellophanierung der Single Tests bzw. durch einen Sicherheitsverschluss bei Klinikpackungen gewährleistet.
Weiterhin wird jede Packung des Arzneimittels mit einer individuellen Seriennummer versehen. Die Seriennummern werden in der Datenbank des entsprechenden nationalen Verifikationssystems gespeichert. Vor der Ausgabe des Arzneimittels an den Patienten, in der Regel durch eine Apotheke, wird dessen Seriennummer mit den gespeicherten Seriennummern abgeglichen. Ist die Seriennummer dort hinterlegt, handelt es sich um ein Originalpräperat. Es wird an den Patienten ausgegeben. Ist die Seriennummer jedoch nicht hinterlegt, handelt es sich bei dieser Packung um eine Fälschung. Diese wird durch den Apotheker gesperrt.
Zur Umsetzung der Fälschungsschutzrichtlinie hat INFAI seine Verpackungslinie mit modernster Technik ausgerüstet. Damit hat INFAI die Möglichkeit, alle geforderten Sicherheitsmerkmale einschließlich der individuellen Seriennummern in hohe Qualität zu aufzubringen und die erforderlichen Daten sicher an die Datenbanken der nationalen Verifikationssysteme zu übermitteln. Durch diese Maßnahmen gewährleisten wir den höchst möglichen Schutz der Patienten vor Fälschungen unserer Arzneimittel.
Video Link: Falsfied medicines
Referenzen
- World Health Organization WHO (1994)
Classification of Helicobacter pylori as a category 1 carcinogen. (Lancet 344) - Current European concepts in the management of Helicobacter pylori infection
The Maastricht Consensus Report. (Gut 1997; 41: 8-13) - Current concepts in the management of Helicobacter pylori infection
The Maastricht 2-2000 Consensus Report. (Aliment Pharmacol Ther 2002; 16: 167-180) - Current concepts in the management of Helicobacter pylori infection
The Maastricht III Consensus Report (Gut 2007; 56: 772-781) - Management of Helicobacter pylori infection
The Maastricht IV / Florence Consensus Report (Gut 2012; 61: 646-664) - Management of Helicobacter pylori infection
The Maastricht V / Florence Consensus Report (Gut 2017; 66: 6-30)
INFAI Publikationen
- Hawkey C., Avery A., Coupland C., Crooks C., Dumbleton J., Hobbs R., Kendrick D., Moore M., Morris C., Rubin G., Smith M., Stevenson D. (2022) Helicobacter pylori eradication for primary prevention of peptic ulcer bleeding in older patients prescribed aspirin in primary care (HEAT): a randomised, double-blind, placebo-controlled trial. Lancet 2022; 400:1597-606
- Dumbleton J.S., et al. (2015)
The Helicobacter Eradication Aspirin Trial (HEAT): A Large Simple Randomised Controlled Trial Using Novel Methodology in Primary Care. EBioMedicine 2: 1200–1204 - Tepeš B., Malfertheiner P., Labenz J., Aygen S. (2017)
Modified Helicobacter test using a new test meal and a ¹³C-urea breath test in Helicobacter pylori positive and negative dyspepsia patients on proton pump inhibitors. World J Gastroenterol 23(32): 5954-5961. - Significant decrease in prevalence of H. pylori in the Czech Republic.
Bureš et al.; WJG, 2012, 18(32): 4412. - Comparison of non-invasive tests to detect Helicobacter pylori infection in children and adolescents
Results of a multicenter European study.
Mégraud, F. et al.; The Journal of Pediatrics, 2005, 146(2): 198. - Albarti, A. (2002)
Utility and acceptability of INFAI C-13-urea breath test. BMS 324: 485 - (2001)
INFAI breath test in general practice. Cleveland Med. J. 4: 116-8. - Labenz J., Aygen S., Hennemann 0., Peitz U., Tillenburg B., Börsch G., Stolte M. (1995) Validity of a novel biopsy urease test (HUT) and a simplified ¹³C-urea breath test for diagnosis of Helicobacter pylori infection and estimation of the severity of gastritis. Digestion 57(6): 391-7.
- Labenz J., Stolte M., Aygen S., Hennemann O., Bertrams O., Börsch G. (1993)
Qualitative und semiquantitative invasive und nicht-invasive Diagnostik der Helicobacter pylori-Kolonisation der gastralen Mukosa. Z Gastroenterol 31(7-8): 437-43.
Studien zum Helicobacter Test INFAI
Studie: PPI; Eudra CT Number: 2008-008010-39
The Sensitivity and Specificity in Helicobacter Pylori Positive and Negative Patients with Dyspepsia Taking Proton Pump Inhibitors. Sponsor: INFAI
Studie: Aptalis; Eudra CT Number: 2010-019064-36
Efficacy and Safety of PYLERA (Bismuth Subcitrate Potassium, Metronidazole, and Tetracycline Hydrochloride) With Omeprazole Given x 10 Days in Subjects Who Failed Treatment for Eradication of Helicobacter pylori. Sponsor: Aptalis
Studie: HEAT; Eudra CT Number: 2011-003425-96
Helicobacter eradiation to prevent ulcer bleeding in aspirin users: a large simple randomised controlled trial (HEAT). Sponsor: University of Nottingham
Dumbleton J.S., et al. (2015): The Helicobacter Eradication Aspirin Trial (HEAT):
A Large Simple Randomised Controlled Trial Using Novel Methodology in Primary Care. EBioMedicine 2: 1200–1204
Studie: PPI; Eudra CT Number: 2017-001369-25
The Sensitivity and Specificity of the Modified Helicobacter Test INFAI Using New Test Meal with 13C-Urea Breath Test in Helicobacter pylori Positive and Negative Patients with Dyspepsia and GERD Taking Proton Pump Inhibitors.
Sponsor: INFAI
Patente
Patent for modified breath test (for Patients taking PPI)
EP1685851, Method for the diagnosis of Helicobacter pylori infection and a diagnostic kit for performing the method,
European Patent, 13.05.2009
US20030032081, Method for the diagnosis of Helicobacter pylori infection and a diagnostic kit for performing the method,
US Patent, 13.02.2013
Heliblue Patent
EP1415159, Method and Diagnostic Kit for diagnosis of Helicobacter pylori,
European Patent, 24.10.2007
US7033838, Method for the diagnosis of Helicobacter pylori infection and a diagnostic kit for performing the method,
US Patent, 25.04.2006
WO2003014744, Method and Diagnostic Kit for diagnosis of Helicobacter pylori,
International Patent, 22.02.2003
